RESUMO
OBJETIVOS: avaliar o efeito da Imunoterapia Orofaríngea de Colostro na redução dos casos de sepse neonatal tardia, em recém-nascidos prematuros com muito baixo peso.
MÉTODOS: trata-se de um estudo de intervenção, com análise comparativa entre a incidência de sepse neonatal tardia do grupo tratamento (em uso da Imunoterapia Orofaríngea de Colostro) e grupo controle histórico (recém-nascidos acompanhados na mesma unidade de terapia intensiva neonatal, anteriormente à implementação do protocolo de Imunoterapia Orofaríngea de Colostro). Participaram do estudo 81 prematuros nascidos entre 2016 e 2022, separados de acordo com o recebimento ou não da Imunoterapia Orofaríngea de Colostro. A intervenção consistiu em oito aplicações diárias de 0,2 mL de colostro cru da própria mãe na mucosa oral dos participantes, durante os sete primeiros dias de vida. Foi feito cálculo de Risco Relativo e Redução Absoluto de Risco e do Número Necessário para Tratar.
RESULTADOS: notou-se efeito protetor da IOC contra a sepse neonatal tardia. Risco relativo: 0,43; IC95%=0,21-0,91; Redução absoluta de risco: 0,26; IC95%=6,51-45,92 e Número necessário para tratar: 4 (2,17-15,34).
CONCLUSÃO: a administração orofaríngea de colostro se mostrou uma medida promissora na proteção de RNPT com MBP contra sepse tardia.
Palavras-chave:
Recém-nascido prematuro, Colostro, Sepse neonatal, Imunoterapia, Estudos de intervenção
ABSTRACT
OBJECTIVES: to evaluate the effect of oropharyngeal colostrum immunotherapy in reducing cases of late-onset neonatal sepsis in preterm infants with very low birth weight.
METHODS: this is an intervention study, with a comparative analysis between the incidence of late-onset neonatal sepsis in the treatment group (in use of oropharyngeal colostrum immunotherapy) and the historical control group (newborns monitored in the same intensive care unit prior to the implementation of the oropharyngeal colostrum immunotherapy protocol). 81 premature babies born between 2016 and 2022 participated in the study, separated according to whether or not they received oropharyngeal colostrum immunotherapy. The intervention consisted of eight daily applications of 0.2 mL of the mother's own raw colostrum to the newborns oral mucosa during the first seven days of life. Relative Risk and Absolute Risk Reduction and Number needed to Treat were calculated.
RESULTS: a protective effect of oropharyngeal colostrum immunotherapy against late neonatal sepsis was noted. Relative Risk: 0.43; CI95% = 0.21-0.91; Absolute Risk Reduction: 0.26; CI95%= 6.51 - 45.92 and Number Needed to Treat: 4 (2.17-15.34).
CONCLUSION: administration of oropharyngeal colostrum proved to be a promising measure in protecting preterm newborns with VLBW against late-onset sepsis.
Keywords:
Premature newborn, Colostrum, Neonatal sepsis, Immunotherapy, Intervention studies
IntroduçãoRecém-nascidos pré-termo (RNPT), aqueles nascidos com menos de 37 semanas gestacionais
1, apresentam maior risco de complicações, incluindo as infecciosas, a exemplo da sepse neonatal.
2 A prematuridade pode ter ainda como consequência o muito baixo peso ao nascer, peso de nascimento inferior 1500 gramas, condição esta que aumenta a vulnerabilidade do recém nascido.
3A sepse neonatal tardia é condição clínica decorrente da infecção desenvolvida após 72 horas de vida, que pode ser de etiologia bacteriana, viral ou fúngica, com acometimento de fluidos corporais, como sangue, urina ou líquor, com frequente manifestações sistêmicas, resultantes de repercussões em órgãos e tecidos e alterações hemodinâmicas.
4 A imaturidade imunológica apresentada pelos RNPT está envolvida na fisiopatologia da sepse.
O fornecimento de leite materno promove benefícios para o sistema imunológico do neonato, colaborando para a redução da incidência de infecção e mortalidade neonatal, através da manutenção das funções de barreira, proteção do epitélio gastrointestinal, e inibição da colonização de bactérias patogênicas.
5,6No entanto, para muitos RNPT com peso inferior a 1.500 gramas ao nascer, não se faz possível o estabelecimento da alimentação enteral, logo após o nascimento, em virtude das complicações clínicas comumente apresentadas. Adicionalmente, uma vez iniciada, a terapia nutricional enteral geralmente é administrada por sonda orogástrica, privando o contato da mucosa orofaríngea do RNPT com o leite materno até que este esteja apto para receber a alimentação por via oral - por volta de 34 semanas gestacionais.
7A imunoterapia orofaríngea do colostro (IOC), com aplicação de colostro materno na mucosa orofaríngea, antes do início da alimentação, tem despontado como uma estratégia de estímulo imunológico, com demonstração da redução da incidência de complicações infecciosas,
8,9 devido à diminuição do estado pró-inflamatório,
10 aumento nos níveis de imunoglobulina A secretora e lactoferrina
11, além de favorecer o estabelecimento precoce da nutrição por via enteral.
12Diante do exposto, o objetivo deste artigo foi avaliar o efeito da IOC na ocorrência de casos de sepse neonatal tardia em RNPT com MBP ao nascer.
MétodosTrata-se de um estudo de intervenção, com análise comparativa da incidência de sepse neonatal tardia entre o grupo exposto (tratamento) e não exposto à IOC (controle). O estudo foi conduzido com RNPT de MBP ao nascer, nascidos no período de 2016 a 2022, em uma maternidade do Sistema Único de Saúde (SUS) do estado da Bahia.
O grupo tratamento foi composto por RNPT com MBP admitidos em UTIN e clinicamente estáveis. O grupo controle foi formado por um grupo controle histórico, composto por RNPT com MBP internados na mesma unidade, entre os anos 2016 e 2018, período anterior a implementação do protocolo de IOC na unidade, quando a técnica ainda não era realizada.
As informações relativas às condições clínicas, registradas pela equipe de assistência ao RNPT, foram coletadas diariamente dos prontuários até a alta hospitalar por profissionais de saúde treinados para o reconhecimento dos dados e preenchimento de questionário específico. Os mesmos profissionais coletaram retroativamente os dados dos prontuários do grupo controle histórico.
Participaram do estudo os RNPT com MBP que iniciaram o recebimento de IOC antes das 72 horas de vida e que receberam pelo menos 75% das doses programadas até o sétimo dia de vida (mínimo 42 de 56 doses). Os critérios de não inclusão foram: história materna de drogas, presença de distúrbio psicológico, multiparidade (trigêmeos e mais) e mães com contraindicações para a amamentação. Quanto aos critérios de exclusão do RNPT utilizou-se: uso de drogas vasopressoras (> 10 mcg/Kg/min), necessidade de intervenção cirúrgica imediata, presença de síndromes ou malformações congênitas e óbito neonatal precoce (na primeira semana de vida).
A técnica de IOC consistiu em oito aplicações diárias de 0,2 mL de colostro cru (da própria mãe), na mucosa oral esquerda e direita, durante os sete primeiros dias de vida completos (56 aplicações no total). Para início do protocolo de IOC, era necessário que os neonatos estivessem estáveis nas três horas antecedentes à aplicação, considerando-se como estabilidade clínica: normotermia, frequência respiratória e cardíaca adequada, pressão arterial dentro da normalidade e saturação de oxigênio ≥93%. O protocolo de IOC instituído no hospital do estudo foi iniciado com o encaminhamento das genitoras ao Banco de Leite Humano (BLH) da unidade, onde após esclarecimentos, foram apoiadas e estimuladas a realizar a extração do colostro, de forma manual ou por meio de bomba (Medela
®).
Uma vez extraído, o colostro foi imediatamente dividido em alíquotas de 0,2 mL, mantidas refrigeradas em seringas estéreis descartáveis e sem agulha, com identificação contendo: nome da mãe; data a ser administrado; data, hora e número do pedido da coleta; validade (uso dentro de 12 horas) e assinatura do coletador. As oito aplicações diárias da IOC durante os sete dias de intervenção foram realizadas pelos profissionais técnicos em enfermagem responsáveis pela assistência ao RNPT na UTIN.
Para definição da ocorrência de sepse neonatal tardia foi considerado o diagnóstico registrado pela equipe médica no prontuário do RNPT e/ou presença de cultura positiva. A equipe de assistência ao RNPT da unidade onde o estudo foi desenvolvido segue as seguintes recomendações para diagnóstico de sepse neonatal: pelo menos uma cultura positiva em fluido corporal após 72 horas de vida, alterações laboratoriais, tais como leucocitose (leucócitos >25000 mm
3), ou leucopenia (leucócitos <5000 mm
3) com desvio à esquerda, plaquetopenia (plaquetas <150000 p/mm
3) e elevação de Proteína C Reativa (PCR) (>6 mg/L).
Além dos casos de sepse definidos pelo diagnóstico médico e/ou cultura positiva, considerou-se também como sepse neonatal tardia quando o RNPT fez uso de antibiótico por tempo superior a cinco dias, necessidade da troca de esquema de antibióticos após cinco dias de vida e/ou introdução de antifúngico, associados aos sinais clínicos de infecção: instabilidade térmica, alterações respiratórias e alterações laboratoriais mencionadas anteriormente. O tempo de corte de cinco dias foi escolhido por ter sido apontado na literatura científica como definição de sepse clínica/suspeita de sepse.
13,14 O tempo de utilização de antibiótico foi avaliado de acordo com a data de início e finalização da medicação (tempo de vida do RNPT na ocasião).
Os neonatologistas locados na UTIN seguem, habitualmente, a rotina previamente definida para prematuros, sendo o primeiro esquema de partida composto por antibióticos de menor espectro de ação (ampicilina ou penicilina G cristalina e gentamicina), do segundo (oxacilina e amicacina) e terceiro esquema (cefepime, vancomicina, meropenem, ceftraxiona, clindamicina, ceftadizima).
O cálculo amostral foi realizado com a ajuda do
software EPI INFO 7.2.5.0, utilizando-se os seguintes parâmetros: poder de 80%, erro amostral de 5%, intervalo de 95% de confiança, razão de 1:1, prevalência de 92% de sepse neonatal e risco relativo de 1,84, conforme estudo de Lee
et al.,
11 perfazendo o total de 44 participantes e adicionado previsão de perda de 15%, sendo definido necessidade de 52 participantes, distribuídos 26 no grupo exposto e 26 no grupo controle.
A intervenção ocorreu por conveniência, de modo que todos os RNPT que atendessem aos critérios estariam aptos a receber a IOC e participar do estudo após convite e consentimento esclarecido materno.
Na análise descritiva foram obtidas as frequências simples e relativas das variáveis e covariáveis categóricas. A normalidade dos dados foi avaliada pelo teste Shapiro-Wilk, confirmando-se a assimetria dos dados. Dessa forma, foi utilizada mediana e intervalo interquartílico como medidas de tendência central e dispersão, respectivamente, para os dados quantitativos.
Devido à questão supracitada, utilizou-se o teste de Mann Whitney para comparação das covariáveis contínuas entre os grupos. O teste qui-quadrado de Pearson e exato de Fisher foi empregado conforme apropriado (número de eventos por célula), para avaliar a distribuição das variáveis categóricas entre os grupos de comparação.
A análise de sepse neonatal tardia foi ajustada por idade materna, situação conjugal, hipertensão gestacional, tipo de parto, número de consultas pré-natal e peso ao nascer. Foram calculados o risco relativo (RR) e redução absoluta de risco (RAR) e do número necessário para tratar (NNT).
O presente trabalho foi submetido e aprovado pelo Comitê de Ética da Universidade Estadual de Feira de Santana (UEFS), com parecer de número 2.930.252. O estudo encontra-se cadastrado no Registro Brasileiro de Ensaio Clínico (ReBEC) sob o registro RBR-2cyp7c e UTN U1111-1222-0598.
ResultadosA Figura 1 descreve o fluxograma de recrutamento dos RNPT participantes do estudo.
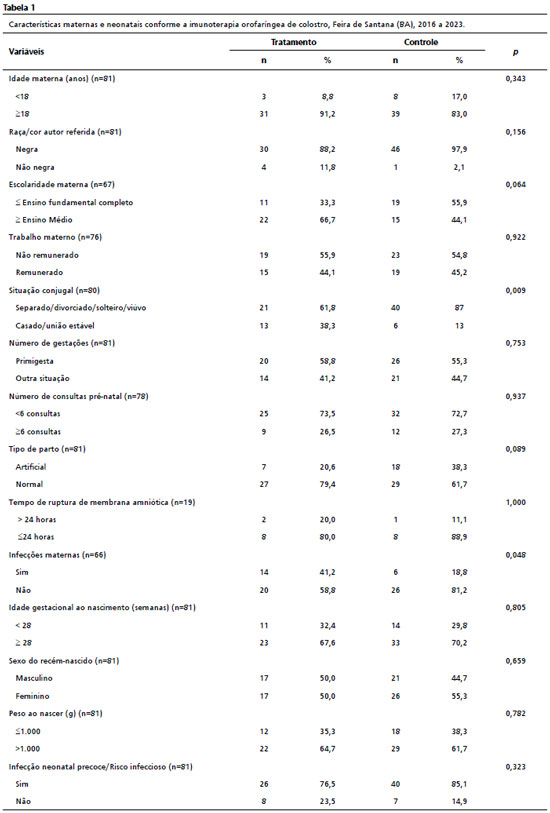
A Tabela 1 descreve as características sociodemográficas maternas e condições de nascimento dos RN participantes do estudo. A maioria das mulheres apresentavam mais de 18 anos de idade, se auto referiram como negras, possuíam ensino médio completo, porém majoritariamente desenvolviam trabalho não remunerado e situação conjugal do tipo solteira, divorciada ou viúva; eram primigestas e não fizeram pré-natal completo, evoluindo para parto prematuro natural com tempo de ruptura de membranas amnióticas inferior a 24 horas, sem registro de infecção materna no periparto (urinária, corioamnionite, Estreptococos do grupo B e outras infecções no periparto). Quanto aos RN, observou-se maior número de prematuros com idade gestacional ≥28 semanas ao nascimento e com peso superior a 1.000 gramas. Além disso, 81% dos RN da amostra apresentaram infecção precoce e/ou risco infeccioso.
A Tabela 2 apresenta as condições clínicas e de internamento dos RN. Em relação ao uso de antimicrobianos pelos RNPT, no grupo tratamento e controle a mediana do tempo de início do uso de antibiótico foi o primeiro dia de vida. Observou-se no grupo tratamento que prematuros que recebem IOC permaneceram por menos tempo em uso de cateter venoso central (valor de
p=0,040), porém com maior tempo de uso de cateter central de inserção periférica (valor de
p=0,008) e apresentavam maior idade na suspensão de nutrição parenteral (
p=0,029).
A necessidade de antifúngico terapêutico (após 72 horas de vida) na amostra foi de 18,5%, correspondente a 15 utilizações, sendo quatro no grupo tratamento e 11 no grupo controle (
p=0,250).
Ocorreram trocas do esquema antibioterápico em aproximadamente 69% dos casos (55 RN), dentre esses, seis RNPT já iniciaram o uso de antibiótico a partir do segundo esquema, com posterior troca para um esquema de maior espectro. Destas 55 trocas de esquema antibioterápico ocorridas, 22 trocas ocorreram no grupo tratamento e 33 no grupo controle (
p=0,502). Ainda sobre as trocas realizadas, dez RN fizeram uso do segundo esquema após as 72 horas de vida, enquanto 53 RN fizeram uso do terceiro esquema após esse mesmo período.
Observam-se mudanças de N nas Tabelas 1 e 2 para alguns desfechos decorrentes da ausência de informação em prontuário de alguns participantes da pesquisa.
A avaliação da sepse tardia está apresentada na Tabela 3. O Risco relativo de 0,43 (IC95%=0,21-0,91) indicou que a IOC se comportou como fator de proteção contra o risco de desenvolver sepse neonatal tardia, com redução de 26% dos casos em decorrência seu uso (RAR=0,26; IC95%=6,51-45,92
). Foi observado um número necessário para tratar (NNT) de quatro (IC95%=2,17-15,34). Dos 29 casos de sepse tardia ocorridos na amostra, 15 foram confirmados por diagnóstico médico e/ou hemocultura e 14 foram consideradas sepse tardia a partir dos critérios de sepse clínica/suspeita de sepse citados na metodologia.
DiscussãoA incidência de sepse neonatal tardia foi menor no grupo tratamento, quando comparado ao controle, confirmando o pressuposto de IOC como fator de proteção contra esta patologia. Resultados similares foram observados no estudo de Ouyang
et al.
14 realizado na China, no qual foram aplicados os mesmos critérios diagnósticos para sepse tardia e nenhum tipo de intervenção no grupo controle (cuidados de rotina), onde constatou-se que o número de casos de sepse tardia foi menor no grupo tratamento que no grupo controle. De modo semelhante, o estudo de Sudeep
et al.
15 publicado em 2022 na Índia, utilizando um protocolo de IOC muito similar ao aplicado neste trabalho, também demonstrou a diminuição de sepse tardia no grupo tratamento.
Em consonância com os resultados encontrados, uma recente revisão sistemática com metanálise, publicada em 2023 por Yan
et al.,
16 demonstrou que a IOC é eficiente em reduzir a incidência de sepse neonatal tardia, fato também suportado por outras revisões sistemáticas publicadas em 2022
9 e em 2020,
17 embora a revisão produzida por Slouha
et al.
18 não tenha observado os mesmos achados.
Do mesmo modo, Leonardo
et al.
19 encontraram maior incidência de sepse no grupo controle que no grupo tratado com colostro materno pasteurizado no estudo realizado em um hospital italiano. Diferentemente do referido estudo, o presente trabalho utilizou na IOC colostro materno cru, com extração até as primeiras 72 horas após o parto.
A preferência pela aplicação na mucosa oral de colostro cru, reside no fato de que o tratamento térmico do leite humano, utilizado na pasteurização, provoca redução dos componentes bioativos, tais quais imunoglobulinas, lactoferrina, lisozima, citocinas.
20 Por sua vez, a realização da IOC com colostro cru preserva a atividade dos imuno componentes que exercem as funções bactericidas/bacteriostáticas, fato que pode ter contribuído para diminuição da incidência de sepse tardia no grupo tratamento.
É pertinente comentar sobre as condições clínicas de recém-nascidos pré-termos incluídos na amostra. Notou-se que o tempo, para suspensão da nutrição parenteral e PICC, foi maior no grupo tratamento que no grupo controle. A utilização da via intravenosa é item fundamental na assistência de RNPT, especialmente para a administração de antibiótico e de nutrição parenteral. Embora esses dados possam sugerir um pior desfecho neste grupo, pode-se hipotetizar que o grupo tratamento teve extensão de tempo em uso desses dispositivos, por ter maior chance de ser tratado (maior tempo de permanência na UTI) e de sobreviver. Estudo de Martins
et al.,
21 realizado com esta mesma população e mesmo local de estudo demonstrou que a utilização do colostro orofaríngeo diminuiu o risco de morte no grupo de intervenção.
Ainda sobre o uso do PICC, quando comparado ao cateter venoso central, este procedimento apresenta menor risco de complicações, a exemplo de complicações sistêmicas e de inserção.
22 Por conta disso, houve nos últimos anos um aumento significativo na utilização desse tipo de dispositivo, além do aumento de profissionais capacitados para realizar a sua inserção. A partir dessa mudança no panorama assistencial é possível conjecturar que a maior utilização de PICC no grupo tratamento, em comparação com o grupo controle, tenha ocorrido também pela diferença temporal da coleta de dados dos dois grupos (controle de 2015 a 2018 e tratamento de 2019 a 2022).
Para explicar a maior idade do grupo tratamento na época da suspensão de nutrição parenteral pode-se usar o mesmo raciocínio de que o aumento da chance de sobrevivência e da menor mortalidade neonatal associado a IOC
21 implicou no tempo de uso de recursos hospitalares, a exemplo da nutrição parenteral.
É relevante pontuar que o tipo e o tempo de dispositivo intravenoso utilizado, bem como o tempo da nutrição parenteral pode ser justificado por possíveis mudanças no modelo assistencial à época do grupo controle e do grupo tratamento.
Observamos uma tendência, sem significância estatística, sugerindo que o grupo controle necessitou de maior mudança no esquema de antibióticos e também maior necessidade de uso de antifúngico após 72 horas de vida, o que sinaliza uma tendência da piora infecciosa nesse grupo e corrobora com os achados de maior número de sepse para esses RN. Em consonância aos casos de sepse na população, a utilização de antibióticos de maior espectro, como vancominica, meropenem e cefepime, são tipicamente utilizados no tratamento da sepse tardia neonatal.
23 A necessidade de antifúngico também pode ser explicada pela vulnerabilidade dos RNPT às infecções fúngicas.
24Não foi observada redução no tempo de utilização de antibiótico pelo uso da IOC. A revisão sistemática de Nasuf
et al.,
25 publicada em 2018, também não sinalizou impacto da IOC na utilização e dias de uso de antibiótico. É provável que a utilização de antibioticoterapia empírica, desde o nascimento em ambos os grupos tenha mascarado os resultados.
Essa conduta terapêutica, iniciada nos primeiros dias de vida para condução da sepse precoce e/ou risco infeccioso, está em consonância com a literatura que demostra a ampla utilização de antibióticos como profilaxia para sepse precoce.
23,26 Ainda nessa perspectiva, a utilização de antibioticoterapia empírica por mais de cinco dias aumenta o risco para sepse neonatal tardia, principalmente em UTIN onde há vasta utilização de antibiótico de amplo espectro e baixa utilização de leite materno.
26,27Sobre as características maternas é preciso comentar que as genitoras do grupo tratamento apresentaram maior prevalência de infecções, característica que sabidamente aumenta o risco infeccioso nos recém-nascidos,
26 que consequentemente necessitarão de maior vigilância no tratamento das infecções. Tal fato também contribui para reforçar o papel de proteção da IOC, uma vez que seria esperado que o grupo de RN filhos de genitoras com maior prevalência de infecções teria maior risco de desenvolver sepse neonatal.
Ainda sobre as características maternas, o número de mulheres com estado civil do tipo separado, divorciado, solteiro ou viúvo foi mais prevalente significantemente no grupo controle que no grupo tratado com IOC. Decerto, a ausência de um parceiro formal ou a falta de reconhecimento de paternidade aumenta as chances de parto prematuro,
28,29 bem como de suas consequências negativas.
Destaca-se como limitação do atual estudo a necessidade de utilização de um grupo controle histórico em detrimento de um grupo controle placebo simultâneo ao grupo tratamento, no entanto, essa foi uma exigência feita pelo comitê de ética ao qual o trabalho foi submetido. É relevante considerar a utilização do colostro da própria mãe cru como terapia imunológica para uma população que habitualmente é submetida a uso prolongado de antibióticos, longo tempo de internação, o uso prolongado de nutrição parenteral, início tardio da nutrição enteral com leite materno, fatores que alteram a microbiota intestinal e aumentam o risco de sepse neonatal por colonização patogênica.
27,30A administração orofaríngea de colostro se mostrou promissora como fator de proteção contra sepse tardia, com redução absoluta de risco desta patologia em 26% dos recém-nascidos do grupo tratamento e grande impacto clínico, pois o tratamento de quatro recém-nascidos prematuros de muito baixo peso foi suficiente para evitar a ocorrência de um evento. Do ponto de vista de Saúde Pública, este resultado fortalece a inserção da IOC no contexto da assistência neonatal, como medida de prevenção de sepse neonatal tardia, patologia que apresenta alta morbidade e mortalidade neonatal, sobretudo para os prematuros.
Referências1. World Healthy Organization (WHO). Preterm Birth. [
Internet] [acesso em 2023 Mai 10]. Disponível em:
https://www.who.int/news-room/fact-sheets/detail/preterm-birth2. Collins A, Weitkamp JH,Wynn JL. Why are preterm newborns at increased risk of infection? Arch Dis Child Fetal Neonatal Ed. 2018 Jul; 103 (4): F391-4.
3. Fleiss N, Tarun S, Polin RA. Infection prevention for extremely low birth weight infants in the NICU. Seminars. Fetal Neonatal Med. 2022; 27 (3): 101345.
4. Shane AL, Sánchez PJ, Stoll, BJ. Neonatal sepsis. Lancet. 2017; 390 (10104): 1770-1780.
5. Lewis ED, Richard C, Larsen BM, Field CJ. The Importance of Human Milk for Immunity in Preterm Infants. Clin Perinatol. 2017; 44 (1): 23-47.
6. Li D-F, Shi C-X, Zhao L, Shi F-Z, Jiang M-L, Kang W-Q. Prevention of neonatal ventilator-associated pneumonia through oral care with the combined use of colostrum and sodium bicarbonate. Eur Rev Med Pharmacol Sci. 2021; 25 (5): 2361-6.
7. Rodriguez NA, Vento M, Claud EC, Wang CE, Caplan MS. Oropharyngeal administration of mother’s colostrum, health outcomes of premature infants: study protocol for a randomized controlled trial. Trials. 2015; 16 (1): 453.
8. Cai M, Lin L, Peng Y, Chen L, Lin Y. Effect of Breast Milk Oral Care on Mechanically Ventilated Preterm Infants: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. Front Pediatr. 2022; 10: 899193.
9. Huo M, Liu C, Mei H, Zhang Y, Liu C, Song D,
et al. Intervention Effect of Oropharyngeal Administration of Colostrum in Preterm Infants: A Meta-Analysis. Front Pediatr. 2022; 10: 895375.
10. Martín-Álvarez E, Diaz-Castro J, Peña-Caballero M, Serrano-López L, Moreno-Fernández J, Sánchez-Martínez B,
et al. Oropharyngeal Colostrum Positively Modulates the Inflammatory Response in Preterm Neonates. Nutrients. 2020; 12 (2): 413.
11. Lee J, Kim HS, Jung YH, Choi KY, Shin SH, Kim EK,
et al. Oropharyngeal colostrum administration in extremely premature infants: an RCT. Pediatrics. 2015; 135 (2): e357-366.
12. Ramos MDSX, Martins CDC, Souza ES, Vieira GO, Gomes-Filho IS, Figueiredo ACMG,
et al. Oropharyngeal colostrum immunotherapy and nutrition in preterm newborns: meta-analysis. Rev Saúde Pública. 2021; 55: 59.
13. Glass K, Greecher C, Doheny K. Oropharyngeal Administration of Colostrum Increases Salivary Secretory IgA Levels in Very Low-Birth-Weight Infants. Amer J Perinatol. 2017; 34 (14): 1389–95.
14. OuYang X, Yang CY, Xiu WL, Hu YH, Mei SS, Lin Q. Oropharyngeal administration of colostrum for preventing necrotizing enterocolitis and late-onset sepsis in preterm infants with gestational age ≤ 32 weeks: a pilot single-center randomized controlled trial. Int Breastfeed J. 2021; 16 (1): 59.
15. Sudeep KC, Kumar J, Ray S, Dutta S, Aggarwal R, Kumar P. Oral Application of Colostrum and Mother’s Own Milk in Preterm Infants—A Randomized, Controlled Trial. Indian J Pediatr. 2022; 89 (6): 579-86.
16. Fu ZY, Huang C, Lei L, Chen LC, Wei LJ, Zhou J,
et al. The effect of oropharyngeal colostrum administration on the clinical outcomes of premature infants: A meta-analysis. Int J Nurs Stud. 2023; 144: 104527.
17. Tao J, Mao J, Yang J, Su Y. Effects of oropharyngeal administration of colostrum on the incidence of necrotizing enterocolitis, late-onset sepsis, and death in preterm infants: a meta-analysis of RCTs. Eur J Clin Nutr. 2020; 74 (8): 1122-31.
18. Slouha E, Anderson ZS, Mansa N, Kalloo AE, Vasavi RG. Colostrum and Preterm Babies: A Systematic Review. Cureus. 2023; 15 (7): e42021.
19. Leonardo SWM, Ilao MAL, Juico MM. Efficacy of Oropharyngeal Administration of Pasteurized Colostrum in Very Low Birthweight Newborns in Reducing Late Onset Sepsis at a Tertiary Government Hospital in Manila City: A Randomized Control Trial. Acta Med Philipp. 2022; 56 (16).
20. Wesolowska A, Sinkiewicz-Darol E, Barbarska O, Bernatowicz-Lojko U, Borszewska-Kornacka MK, van Goudoever JB. Innovative Techniques of Processing Human Milk to Preserve Key Components. Nutrients. 2019; 11 (5): 1169.
21. Martins CC, Ramos MDSX, Amaral MVC, Costa JSP, Cerqueira ES, Vieira TDO,
et al. Colostrum oropharyngeal immunotherapy for very low birth weight preterm infants: protocol of an intervention study. BMC Pediatr. 2020; 20 (1): 371.
22. Bahoush G, Salajegheh P, Anari AM, Eshghi A, Aski BH. A review of peripherally inserted central catheters and various types of vascular access in very small children and pediatric patients and their potential complications. J Med Life. 2021 Jun; 14 (3): 298-309.
23. Puopolo SK. Infecções Bacterianas e Fúngicas. In: Cloherty JP, Eichenwald EC, Stark AR. Manual de neonatologia. 7ª ed. Rio de Janeiro: Guanabara Koogan; 2015. p. 490-515.
24. Weimer KED, Smith PB, Puia-Dumitrescu M, Aleem S. Invasive fungal infections in neonates: a review. Pediatr Res. 2021; 91 (2): 404-12.
25. Nasuf AWA, Ojha S, Dorling J. Oropharyngeal colostrum in preventing mortality and morbidity in preterm infants. Cochrane Database Syst Rev. 2018; 9 (9): CD011921.
26. Procianoy RS, Silveira RC. The challenges of neonatal sepsis management. J Pediatr (Rio J). 2020; 96 (S1): 80-6.
27. Dong Y, Speer CP. Late-onset neonatal sepsis: recent developments. Arch Dis Child Fetal Neonatal Ed. 2015; 100 (3): F257–F263.
28. Thoma ME, Drew LB, Hirai AH, Kim TY, Fenelon A, Shenassa ED. Black–White Disparities in Preterm Birth: Geographic, Social, and Health Determinants. Am J Prev Med 2019; 57 (5): 675-86.
29. Lessa MSA, Nascimento ER, Coelho EAC, Soares IJ, Rodrigues QP, Santos CAST,
et al. Pré-natal da mulher brasileira: desigualdades raciais e suas implicações para o cuidado. Ciênc Saúde Colet. 2022; 27 (10): 3881-90.
30. Madan JC, Salari RC, Saxena D, Davidson L, O’Toole GA, Moore JH,
et al. Gut microbial colonisation in premature neonates predicts neonatal sepsis. Arch Dis Child Fetal Neonatal Ed. 2012; 97 (6): F456–F462.
Contribuição dos autoresSantos GC: coleta e análise dos dados, escrita do manuscrito. Vieira TO: desenho metodológico, análise dos dados, revisão do manuscrito. Martins CC: desenho metodológico, coleta e análise dos dados, revisão do manuscrito. Costa MGR: coleta dos dados, revisão do manuscrito. Vieira GO: administração do projeto, aquisição de financiamento, desenho metodológico, revisão do manuscrito. Todos os autores aprovaram a versão final do artigo e declaram não haver conflito de interesse.
Recebido em 28 de Abril de 2024
Versão final apresentada em 24 de Agosto de 2024
Aprovado em 29 de Agosto de 2024
Editora Associada: Gabriela Buccini
 ; Tatiana de Oliveira Vieira 2
; Tatiana de Oliveira Vieira 2 ; Camilla da Cruz Martins 3
; Camilla da Cruz Martins 3 ; Matheus Gomes Reis Costa 4
; Matheus Gomes Reis Costa 4 ; Graciete Oliveira Vieira 5
; Graciete Oliveira Vieira 5